*نکته:بیشتر جرم اتم در هسته اش وجود دارد.
قال هدایی(ع):ایزوتوپ=اتم های یک عنصر که در پروتون ها مساوی ولی در تعداد الکترون ها نابرابر باشند.
مدل اتمی دالتون:
1)ماده از ذرات تجزیه پذیر به نام اتم ساخته شده.
2)اتم های یک عنصر مثل همند.
3)اتم ها از بین یا به وجود نمی آیند.
4)اتم های عناصر مختلف دارای جرم و خواص شیمیایی مختلفند.
5)چند اتم از چند عنصر، با اتصال به هم مولکول ها را به وجود می آورند.
6)در مولکولی از ترکیبی معین، همواره نوع و تعداد اتم های سازنده یکسان است.
7)واکنش های شیمیایی شامل جابجایی اتم ها و یا تغییر در نحوه ی اتصال آنان در مولکول هاست که در آنان نوع اتم تغییر نمی کند.
پدیده هایی که دالتون توجیه نمی کند:
1)پدیده هایی که ناشی از عبور الکترونها در اتمند مثل عبور برق از مواد، الکتریسیته ی، برتکافت یا الکترولیز، ایجاد پرتوی کاتدی، خواص مغناطیسی مواد
2)پدیده های مربوط به هسته ی اتم مثل خاصیت پرتوزایی(رادیواکتیوی) و وجود ایزوتوپ های مختلف برای یک عنصر
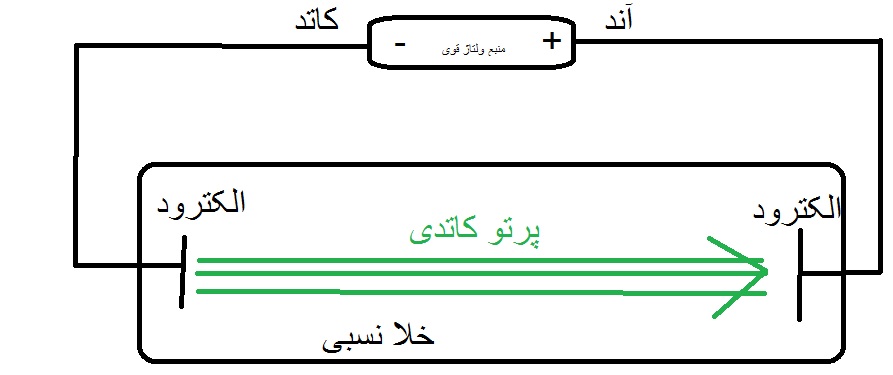
شکل آزمایش تامسون:
ولتاژ بالا برای افزایش تمایل الکترونها در راستای کنده شدن از سطح کاتد به سمت آند.
فشار پایین و خلا نسبی برای کاهش مقاومت اتم ها یا مولکول های گازی در برابر حرکت الکترونها از کاتد به آند.
الکترود ها 2 فلز در 2 طرف شیشه اند که الکترون از آنان کنده شد.
شیشه را با پمپ خلا تخلیه کردند.
نتایج حاصل از آزمایش پرتو کاتدی:
1)پرتوی کاتدی بار منفی دارد چون با برقراری میدان مغناطیسی یا الکتریکی منحرف به سمت آند می شود.
2)پرتوی کاتدی صاف حرکت می کند.
3)پرتوهای کاتدی به هنگام عبور، گاز درون لوله را ملتحب می کنند و بر آن اثر می گذارد.
4)همه ی مواد الکترون دارند چون با تعویض الکترود کاتد، همچنان پرتو داشتیم.(البته این مورد را دقیق و برای تمام مواد تست نکردند.
وقتی بار مثبت در سمتی از این لامپ خلا ایجاد کردند، پرتو به سمت آن رفت و تامسون فهمید که این پرتو بار منفی دارد.
در میان راه پرتو یک پره گذاشتند و سایه به سمت الکترود آند چرخید پس فهمیدند که پرتو از سمت کاتد می آید و از این رو، نام آن پرتو را پرتو ی کاتدی گذاشتند.
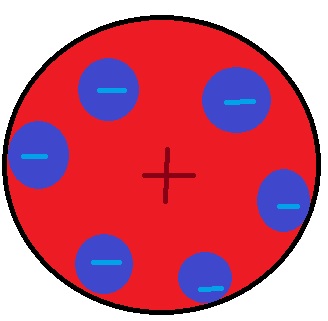
مدل اتمی تامسون:
در این مدل ماده ی مثبت مانند ابری است که هیچ جرمی ندارد و الکترون ها در آن مانند کشمش در کیک پخشند ولی به دلیل بار منفی، از هم بیشترین فاصله را دارند.
تامسون:
1)اتم از ذرات کوچکی با بار منفی به نام الکترون ساخته شده است.
2)بار کلی اتم خنثی است(بار مثبت فضای ابرگونه خنثی کننده ی الکترونهاست).
3)به دلیل دافعه ی بین الکترون ها آنان در بیشترین فاصله با هم قرار دارند.
4)ابر کروی جرم ندارد و جرم را تنها الکترونها معلوم می کنند.
جنس مانع هم در امکان عبور اشعه از مانع تاثیر دارد(به علاوه ی 3 دلیلی که قبلا گفته شد).
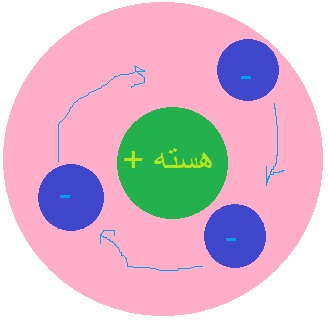
مدل اتمی هسته دار(ارنست رادرفورد):
نتیجه های آزمایش رادرفورد:
1)بیشتر ذرات آلفا بدون انحراف و در مسیری مستقیم حرکت می کردند یعنی بیشتر حجم اتم فضای خالیست.
2)بیشتر ذرات با کمی زاوده از مسیرشان منحرف می شدند یعنی میدان الکتریکی قوی ای در هسته ی اتم وجود دارد.
3)حدود 1/20000 ذرات آلفا با زاویه ای بیش از 90 درجه منحرف می شوند یعنی هسته بسیار کوچک ولی جرم فراوانی دارد که می تواند با این چنین زاویه ای ذرات را برگرداند.
رادرفورد فهمید که تعداد الکترونها با پروتونها برابرست و اتم از نظر بار الکتریکی خنثی است.
او پروتون را برای بار اول کشف کرد!
مشکل این مدل این است که الکترون های دور هسته هیچ حساب و کتاب دقیقی در چرخششان به دور هسته ندارند که در این حالت ممکن است الکترونی بر هسته سقوط کند یا الکترونی از اتم خارج شود.
او آزمایشش را در سال 1911 انجام داد.
جیمز چادویک در سال 1932 با آزمایشهای علمی پیجیده مدل رادرفورد را کامل تر کرد و اثبات کرد که ذراتی به نام نوترون نیز در اتم وجود دارد.
برخی نماد های اتم ها که معروفند:
Al=آلومینیوم
Ca=کلسیم
C=کربن
Cr=کروم
Au=طلا
Ag=نقره
Ni=نیکل
N=نیتروژن
Na=سدیم
O=اکسیژن
P=فسفر
S=گوگرد
K=پتاسیم
Zn=روی
Fe=آهن
H=هیدروژن
He=هلیم
I=ید
F=فلؤر
Mg=منیزیم
Mn=منگنز
Hg=جیوه
قیافه ی یک عنصر در نماد شیمیایی:
بار اتم(اگر منفی یا مثبت باشد) و گرنه میتوان هیچ چیز ننوشت.AZX
X=نام ماده
A=عدد جرمی
Z=عدد اتمی
در نام گذاری ماده، همیشه اولین حرف نام ماده در لاتین را به شکل بزرگ در ابتدای نماد می نویسم و سپس حرف 2 یا 3 یا هیچی را به شکل کوچک در ادامه اش می گذاریم.
کلر:chِlorine=>Cl
هلیم: helium =>He
کربن: carbon=>C
در نوشتن بار اتم، ابتدا میزان اختلاف و سمت راستش مثبت یا منفی را می گذاریم.
فرق مواد فلؤرسانس و فسفرسانس:
مواد فلؤرسانس به محض قطع انرژی ورودی تابش نور از خودشان را قطع می کنند اما مواد فسفرسانس تابش را به مدت زمان کوتاهی پس از قطع انرژی، ادامه می دهند.
مدل لایه ای(ابر الکترونی) (مدل کوانتومی):
در این مدل هم وجود هسته با بار مثبت و حجم زیاد تایید شده.
تفاوت اساسی با مدل بور:
بر خلاف نظریه ی بور که حرکت الکترونها را در مسیر های خاص مجاز می دانست، این نظریه می گوید که الکترونها در دور هسته حرکتی ابرگونه دارند و نه مسیری مشخص.
این توده ی ابرمانند محل حرکت الکترونهاست و اوربیتال نامیده می شود.
*نکته: صفحات76 تا 80 کتاب علامه حلی را به خوبی بخوانید(قال هدایی(ع))
امتحان شیمی خوبی داشته باشید!

 e
e